阿尔茨海默病 (AD) 患者记忆力和自我意识的缓慢衰退是现代医学面临的最严峻挑战之一。当我们目睹挚爱亲朋逐渐陷入认知阴影时,传统疗法的局限性便愈发明显。然而,新兴研究表明,我们或许正在接近一个转折点,再生医学带来的不仅仅是缓解症状,更可能改写疾病的轨迹。
了解阿尔茨海默病的现状
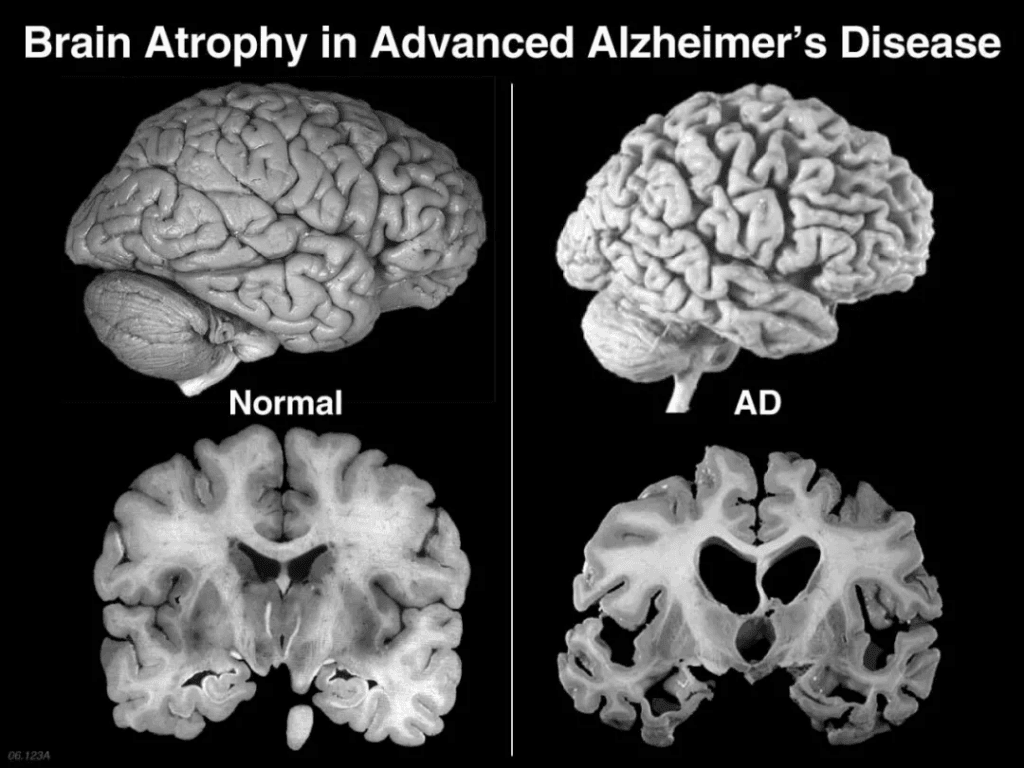
阿尔茨海默病不仅仅是“健忘”。这种神经退行性疾病会逐渐破坏神经元,其病理特征是β淀粉样蛋白斑块和神经原纤维tau蛋白缠结。突触混乱的表现包括记忆力衰退、思维混乱、人格转变,最终导致身体功能丧失。目前FDA批准的药物——乙酰胆碱酯酶抑制剂和NMDA拮抗剂——可以轻微延缓症状,但无法阻止神经退行性疾病。这种治疗困境促使人们探索再生疗法。
hUC-MSCs:不仅仅是简单的细胞替换
人脐带 脐带间充质干细胞 (hUC-MSC) 具有独特的生物学特性,使其成为极具潜力的 AD 治疗药物。与胚胎干细胞不同,这些符合伦理道德的来源细胞具有低免疫原性和强大的免疫调节功能。它们的治疗机制远不止于神经元替代:
旁分泌信号: hUC-MSCs 分泌神经营养因子 (BDNF、GDNF),可拯救受损神经元并刺激突触再生。
小胶质细胞调节: 它们通过将破坏性小胶质细胞转化为神经保护表型来抑制神经炎症。
淀粉样蛋白清除: 通过增强吞噬作用和酶促降解(脑啡肽上调)。
值得注意的是,2022 年 干细胞 研究与治疗 研究表明,AD 小鼠的静脉注射 hUC-MSCs 可将淀粉样蛋白负担减少 40%,并通过选择性归巢至发炎的大脑区域来提高认知分数——这是一种我们才刚刚开始了解的生物“分类”系统。
CRISPR:神经退行性疾病的精密工程
 尽管 干细胞 提供生物“硬件”的同时,CRISPR-Cas9 基因编辑则提供了“软件”升级。这种分子手术刀可以在移植前精确修改干细胞中的疾病相关基因。在阿尔茨海默症(AD)治疗中,CRISPR 增强方法包括:
尽管 干细胞 提供生物“硬件”的同时,CRISPR-Cas9 基因编辑则提供了“软件”升级。这种分子手术刀可以在移植前精确修改干细胞中的疾病相关基因。在阿尔茨海默症(AD)治疗中,CRISPR 增强方法包括:
- APOE4校正: 将高风险的ε4等位基因转换为具有神经保护作用的ε3变体
- BACE1敲除: 通过靶向β-分泌酶基因减少淀粉样变性过程
- 神经营养促进剂: 插入基因以增强 BDNF 或 NGF 的产生
2023 年的一项开创性研究 《自然神经科学》 将 CRISPR 编辑的 MSCs 与纳米颗粒递送技术相结合,在灵长类动物模型中实现了比未编辑细胞高 68% 的淀粉样蛋白清除率。这种协同作用体现了工程细胞如何成为脑内靶向药物工厂。
风暴即将来临——以及前进的道路
预计到2050年,全球阿尔茨海默病病例将增加两倍,达到1.52亿(国际阿尔茨海默病组织,2023年),紧迫性显而易见。最近的临床进展凸显了阿尔茨海默病的潜力:
I/II期临床试验 (NCT03172117, NCT02600130) 表明,hUC-MSC输注可显著改善轻度至中度AD患者的MMSE评分,且疗效可持续至治疗后12个月以上。PET成像显示淀粉样蛋白沉积减少,关键记忆区域的代谢活性得以维持。
然而,挑战依然存在——优化递送方法、防止细胞衰老以及确保长期安全性。目前最有前景的研究集中在组合疗法上:通过鼻腔途径递送CRISPR增强型干细胞,以绕过血脑屏障,并可能与抗tau生物制剂联用。
当我们站在这个跨学科的十字路口时,再生策略带来的不仅仅是渐进式的进步。它们代表着从控制衰老到重建神经完整性的根本性转变。虽然还不是万能药,但干细胞生物学与精准医学的融合 基因编辑 这给我们带来了切实的希望,即有一天我们可以将阿尔茨海默病从绝症转变为可治疗的疾病——不仅保留记忆,还保留身份。
参考: 国际阿尔茨海默病协会 (2023)。世界阿尔茨海默病报告。| Kim 等人 (2022)。干细胞研究与治疗。13(1):489。| Liu 等人 (2023)。自然神经科学。26(5):765-778。| ClinicalTrials.gov 标识符 NCT03172117、NCT02600130。