干细胞如何区别于其他细胞,是我在医学领域研究过的最引人入胜的过程之一。这些主细胞是人体中唯一能够分化成200多种不同特化细胞类型的细胞。它们非常了不起——与寿命有限的普通细胞不同,干细胞能够不断更新,并创造出与自身完全相同的复制品。
干细胞是构成我们身体的基石。您的身体利用它们作为其天然的修复系统。造血干细胞维持血液和免疫细胞,而 间充质干细胞 细胞支撑骨骼、软骨、肌肉和脂肪。我喜欢这些细胞的一点是它们能够分化成不同类型的细胞——从血细胞到神经细胞,再到心肌细胞。这使得它们成为获取医学研究和治疗见解的绝佳途径。
干 细胞疗法 显示出治疗各类疾病的潜力。这一点至关重要,因为约有60%的美国成年人患有慢性疾病,这表明迫切需要新的治疗方法。疾病名单还在不断增加——从关节炎和多发性硬化症到各种癌症和心脏病。当常规治疗无效时,这些细胞带来了希望。
本文将深入探讨细胞重编程的科学原理,以及科学家如何利用干细胞改变医学。我们将探讨驱动细胞发育的因素、引导细胞生长的最快方法,以及干细胞在改善患者护理方面激动人心的临床应用。
干细胞分化的分子基础
图片来源: 临床表观遗传学 – BioMed Central
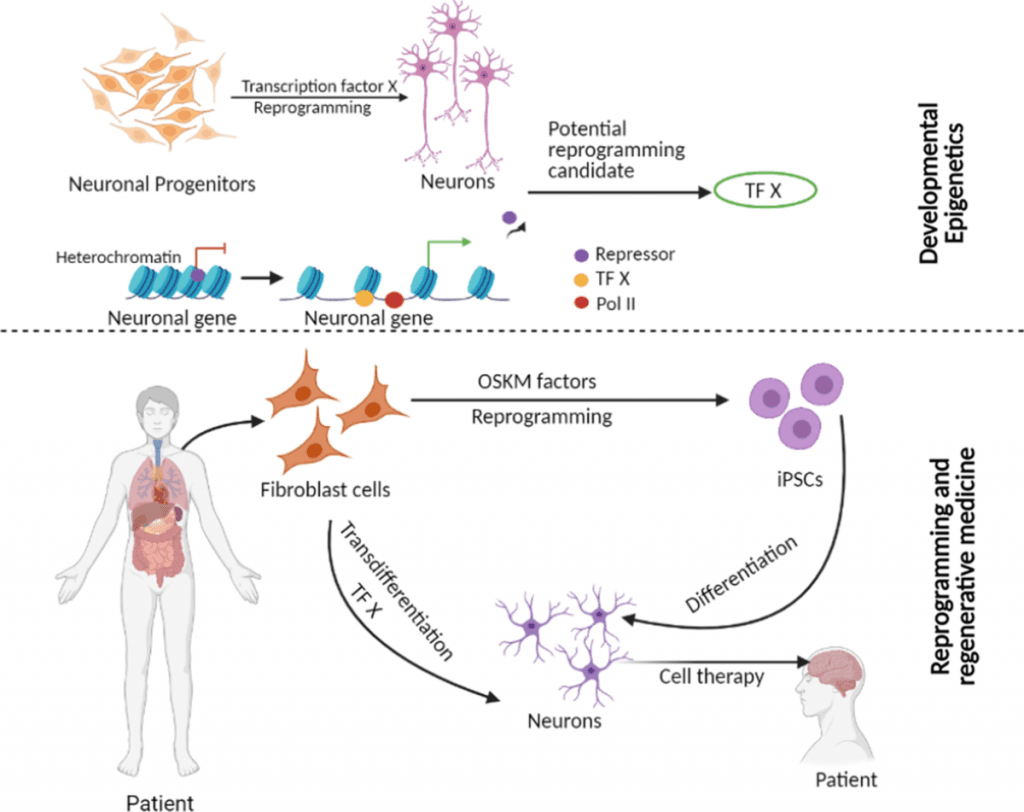
干细胞分离的分子复杂性取决于复杂的遗传和表观遗传机制,这些机制将未分化的细胞转变为功能性、组织特异性的细胞。科学家们现在认为,理解这些机制对于推进再生医学方法至关重要。
多能性与多能性:主要区别
干细胞的分离能力决定了它的细胞潜能。多能性 干细胞 多能干细胞 (PSC) 可以分离成来自所有三个胚层(外胚层、中胚层和内胚层)的细胞。这些细胞无法形成胎盘或脐带等胚外组织。多能干细胞只能分离成特定谱系内密切相关的细胞类型。造血干细胞 (HSC) 专门产生血细胞类型,而间充质干细胞 (MSC) 可发育成骨细胞、软骨细胞、肌肉细胞和脂肪细胞。分离电位的根本差异决定了每种干细胞类型可能治疗的疾病。
谱系承诺中的转录因子
转录因子 (TF) 在干细胞分离过程中起着主要调节作用。多能细胞的核心 TF 包括 OCT4、SOX2 和 NANOG,它们维持自我更新能力。这些因子通过结合特定的 DNA 序列发挥作用,并控制维持干细胞特性所必需的基因表达。
在谱系决定过程中,不同的转录因子会安排细胞命运。例如,参见:
- RUNX2 和 Osterix 引导 MSCs 形成骨
- PPARγ指导脂肪生成
- SOX9控制软骨发生分化
- GATA-1、GATA-2和PU.1调节造血发育
研究表明,即使激活单个谱系特异性 TF 也能将祖细胞转化为不同的谱系。
分化过程中的表观遗传调控
除了转录因子之外,表观遗传机制也显著影响着干细胞的命运。DNA甲基化、组蛋白修饰和非编码RNA调控构成了这些机制。
与自我更新相关的基因逐渐沉默,而谱系特异性基因则在分化过程中被激活。CpG 位点 DNA 甲基化模式的动态变化以及组蛋白的修饰驱动了这一过程。组蛋白 H3K4 的甲基化可激活基因,而 H3K27 的甲基化则使基因沉默。具有相反活性的染色质修饰酶能够实现细胞重编程所需的精确且可逆的调控。
细胞重编程和诱导多能干细胞 (iPSC)
细胞重编程彻底改变了我们对细胞命运可塑性的理解,并为再生医学创造了新的可能性。本节将探讨如何通过基因操作将分化细胞恢复到多能状态。
山中伸弥因素和 iPSC 生成
山中伸弥 (Shinya Yamanaka) 和高桥一俊 (Kazutoshi Takahashi) 于 2006 年取得突破,他们将小鼠成纤维细胞重新编程为诱导多能 干细胞诱导多能干细胞(iPSC)。他们发现了四个关键转录因子——Oct3/4、Sox2、Klf4 和 c-Myc——现在被称为山中伸弥因子,它们可以将体细胞转化为多能干细胞。2007 年,他们在成人真皮成纤维细胞中取得了成功。
这些山中因子能够触发维持多能性的重要发育信号通路。具体来说:
- Oct4 和 Sox2 是调控发育过程的核心因子
- Klf4 改善 Oct4 和 Sox2 活性
- c-Myc 在代谢过程中发挥着独特的作用
体细胞核移植 vs. iPSC 重编程
核重编程主要通过两种方法进行:体细胞核移植 (SCNT) 和诱导多能干细胞 (iPSC) 生成。SCNT 利用未受精卵的细胞质将体细胞基因组重编程为全能状态。这代表了最完整的表观遗传重编程过程。iPSC 技术则采用了一种不同的方法,它通过暂时过表达转录因子来重置体细胞,而无需人类卵子。
两种方法都可以创建患者特异性的多能干细胞。体细胞核移植(SCNT)在各种脊椎动物中效果良好,但面临技术、法律和伦理方面的障碍。诱导多能干细胞重编程(iPSC)技术虽然在技术上更简单,但效率和速度远不及SCNT。
重编程细胞中遗传不稳定性的风险
iPSC 前景光明,但也引发了人们对基因组完整性的担忧。比较基因组杂交分析显示,重编程细胞中存在缺失和扩增。这些特征指向致癌基因诱导的 DNA 复制压力。基因组变化很大程度上取决于 c-Myc 的表达。
该过程效率较低(约0.01-0.1%),这表明该技术存在问题。当科学家阻断p53等肿瘤抑制基因时,p53通路受损的细胞更容易重编程。早期传代iPSC也比中期传代细胞或成纤维细胞含有更多的拷贝数变异。
材料和方法:培养和引导分化
科学家需要精确控制细胞环境才能有效地实现干细胞分化。过去几年,研究团队已经开发出更为先进的方法来培养和引导这些多功能细胞的发育。
多能细胞无饲养层培养系统
小鼠胚胎成纤维细胞 (MEF) 是传统干细胞培养的基础。这些细胞分泌重要的生长因子,例如 TGFβ、促活素 A 和细胞外基质。科学家利用含有层粘连蛋白、IV 型胶原蛋白和硫酸肝素蛋白聚糖的基质胶 (Matrigel) 开发了无饲养层培养的替代品。基质胶通过成分明确的培养基支持干细胞生长,是饲养层依赖型培养的首批替代品之一。由于其来源于小鼠肉瘤,存在异种污染的风险。
科学家开发了更明确的基质,包括特定的层粘连蛋白亚型 (-511/-521)、玻璃粘蛋白和 E-钙粘蛋白。基于合成聚合物的平台提高了使用两性离子水凝胶(例如 PMEDSAH 和氨丙基甲基丙烯酰胺 (APMAAm))的可重复性。石墨烯基表面有望在无需细胞外基质涂层的情况下维持多能性。
定向分化生长因子方案
科学家将细胞暴露于特定的生长因子中,这些生长因子可以反映发育线索,从而指导干细胞分化。基本方案如下:
- 悬浮培养中通过细胞聚集形成胚状体(EB)
- 通过连续生长因子暴露进行单层分化
特定的生长因子组合可指导谱系特异性发育。神经分化需要补充 bFGF、肝素和 N2。十日龄胚泡自然发育成心脏分化,而激活素 A 则驱动内胚层诱导。BMP-4、TGF-β1、视黄酸和 HGF 通过激活不同的信号通路引导细胞走向特定的命运。
用于组织特异性发育的3D类器官模型
科学家们已经超越了简单的分化,创造出能够反映组织结构的复杂3D类器官模型。干细胞利用其在支撑性3D基质中的自组织能力形成类器官。这些结构比传统培养物能够形成更复杂的形态,并提供更准确的组织发育模型。
科学家通过将干细胞嵌入基质胶、海藻酸盐或合成聚乙二醇(PEG)等水凝胶中来构建类器官。基质的物理特性与提供必需营养素的生物反应器相结合,可以促进类器官的发育。这种方法已构建了肠道、大脑、肾脏和肝脏的模型,为疾病建模和药物筛选提供了宝贵的参考。
结果与讨论:分化干细胞的临床应用
过去几年,科学家们已将干细胞治疗的理论可能性转化为实际疗法。他们严谨的研究和临床试验如今已帮助治疗此前无法治愈的疾病。
使用 iPSC 衍生的心肌细胞进行心脏修复
iPSC衍生心肌细胞(iPSC-CM)在治疗心力衰竭和心肌梗死方面展现出显著潜力。将这些细胞移植到受损心脏后,与对照组相比,左心室射血分数提高了8.23%。治疗后4-8周内心脏功能改善最为显著,但治疗效果在此之后逐渐下降。
非人类灵长类动物的研究表明,将iPSC-CM与内皮细胞结合,可增强缺血再灌注后的移植物大小、血管形成和心脏功能。这些改善源于受损组织的肌肉再生和移植物内更好的血管化。
帕金森病模型中的神经再生
iPSC 衍生的神经干细胞 (NSC) 在治疗帕金森病方面展现出巨大潜力。这些 细胞可以 转化为多巴胺能神经元——帕金森病中缺失的主要细胞类型。移植的细胞能够存活下来,并通过多巴胺分泌和营养支持发挥作用。
临床试验证明了神经干细胞移植的安全性,并显示帕金森病患者的运动功能得到改善。敲低SNCA基因的人类iPSC衍生神经干细胞,帮助小鼠模型改善了协调性、平衡性和运动能力。这些小鼠的寿命也得到了延长。
临床试验中干细胞治疗的疾病列表
目前临床试验使用干细胞疗法来治疗许多疾病:
- 血液疾病:白血病、淋巴瘤、多发性骨髓瘤
- 神经系统疾病:帕金森病、阿尔茨海默病、肌萎缩侧索硬化症
- 心血管疾病:心力衰竭、心肌梗塞
- 免疫系统疾病:多发性硬化症、1型糖尿病
- 其他条件:骨关节炎、克罗恩病肛周瘘
几十年来,医生们成功地运用造血干细胞移植(骨髓移植)来治疗血液相关癌症。当常规治疗效果不佳时,干细胞是一种很好的辅助手段。然而,在干细胞广泛应用之前,我们还需要进行更多的研究。
结论
本文探讨了干细胞从未分化状态转变为具有特定功能的特化细胞的奇妙历程。驱动分化的分子机制——从OCT4和SOX2等转录因子到复杂的表观遗传修饰——揭示了指导细胞发育的复杂生物编程。科学家证明,成体细胞可以通过山中伸弥因子重新编程回到多能状态,这无疑彻底改变了我们的认识。然而,这一过程仍然面临着遗传稳定性方面的挑战。
科学家们通过先进的培养技术重塑了干细胞研究的格局。如今,他们运用先进的系统,并从简单的饲养层细胞转向特定基质。复杂的3D类器官模型能够更好地模拟自然组织环境,从而更精确地控制分化途径,并改进人类疾病的建模。
分化干细胞的临床应用正在迅速扩展。这些疗法为医生曾经认为无法治愈的疾病带来了希望,从心脏组织再生到帕金森病的神经细胞移植。许多应用仍处于实验阶段,但造血干细胞移植等成功的治疗方法展现了其真正的潜力。
该领域必须克服未来诸多挑战。科学家需要提高分化效率,确保基因稳定性,并实现临床规模化生产。细胞重编程背后的科学不断发展,干细胞疗法将成为现代医学的重要组成部分。这些疗法将为全球患者提供个性化的治疗方案。从实验室发现到临床治疗的历程表明,基础生物学研究如何重塑临床实践,改变人类生活。