La lente érosion de la mémoire et du soi dans la maladie d'Alzheimer (MA) représente l'un des défis les plus importants de la médecine moderne. Alors que nous voyons nos proches disparaître dans l'ombre cognitive, les limites des thérapies conventionnelles deviennent douloureusement évidentes. Pourtant, de nouvelles recherches suggèrent que nous approchons peut-être d'un point d'inflexion, où la médecine régénératrice offrira plus qu'un soulagement symptomatique : elle pourrait potentiellement réécrire la trajectoire de la maladie.
Comprendre le paysage de la maladie d'Alzheimer
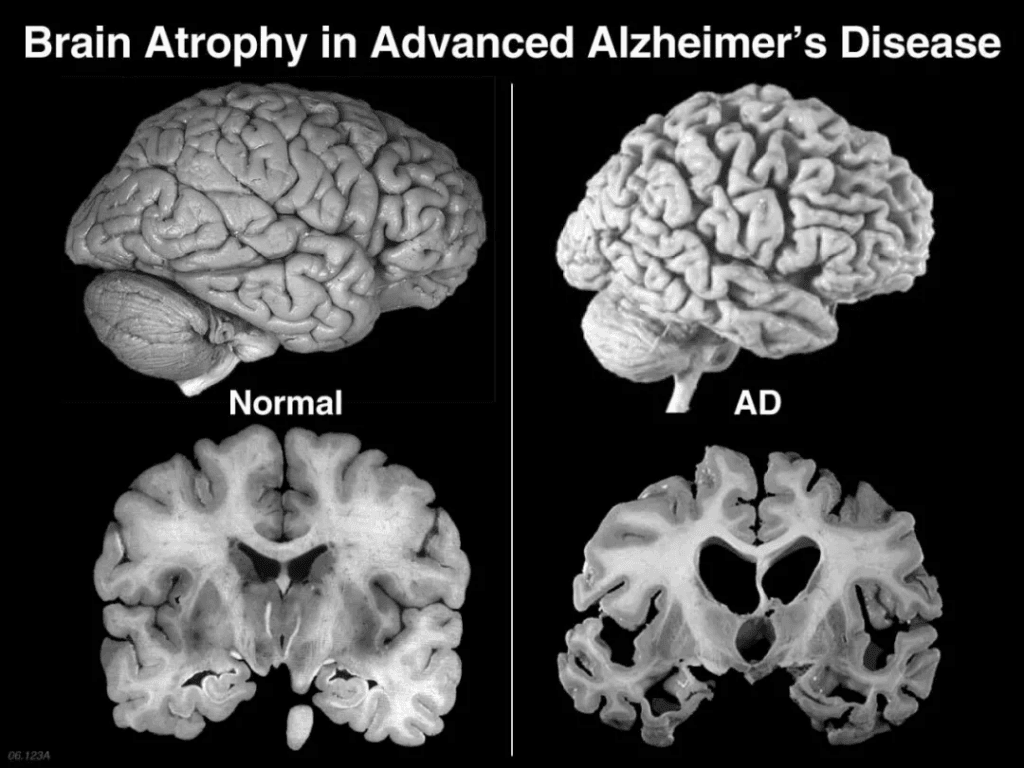
La maladie d'Alzheimer ne se résume pas à des pertes de mémoire. Cette maladie neurodégénérative détruit progressivement les neurones et se caractérise par des plaques bêta-amyloïdes et des enchevêtrements neurofibrillaires de protéines tau. Le chaos synaptique se manifeste par une désintégration de la mémoire, une confusion, des changements de personnalité et, à terme, une perte des fonctions corporelles. Les médicaments actuellement approuvés par la FDA – inhibiteurs de l'acétylcholinestérase et antagonistes NMDA – permettent un léger retard symptomatique, mais ne parviennent pas à stopper la neurodégénérescence. Cette impasse thérapeutique a alimenté l'exploration d'approches régénératives.
hUC-MSC : plus qu'un simple remplacement cellulaire
cordon ombilical humain Les cellules souches mésenchymateuses dérivées du cordon ombilical (hUC-MSC) possèdent des propriétés biologiques uniques qui en font des thérapies prometteuses contre la maladie d'Alzheimer. Contrairement aux cellules souches embryonnaires, ces cellules issues de sources éthiques présentent une faible immunogénicité et de fortes fonctions immunomodulatrices. Leur mécanisme thérapeutique va au-delà du remplacement neuronal :
Signalisation paracrine : Les hUC-MSC sécrètent des facteurs neurotrophiques (BDNF, GDNF) qui sauvent les neurones endommagés et stimulent la régénération synaptique.
Modulation microgliale : Ils suppriment la neuroinflammation en convertissant la microglie destructrice en phénotypes neuroprotecteurs.
Clairance amyloïde : Grâce à une phagocytose améliorée et à une dégradation enzymatique (régulation positive de la néprilysine).
Notamment, un 2022 Cellules souches Recherche et thérapie Une étude a démontré que les hUC-MSC intraveineuses chez les souris atteintes de la maladie d'Alzheimer réduisaient la charge amyloïde de 40% et amélioraient les scores cognitifs en se dirigeant sélectivement vers les régions cérébrales enflammées - un système de « triage » biologique que nous commençons seulement à comprendre.
CRISPR : ingénierie de précision pour la neurodégénérescence
 Alors que cellules souches Outre le « matériel » biologique, l'édition génétique CRISPR-Cas9 offre la mise à niveau « logicielle ». Ce scalpel moléculaire permet de modifier avec précision les gènes associés à la maladie dans les cellules souches avant la transplantation. Dans le contexte de la maladie d'Alzheimer, les approches améliorées par CRISPR comprennent :
Alors que cellules souches Outre le « matériel » biologique, l'édition génétique CRISPR-Cas9 offre la mise à niveau « logicielle ». Ce scalpel moléculaire permet de modifier avec précision les gènes associés à la maladie dans les cellules souches avant la transplantation. Dans le contexte de la maladie d'Alzheimer, les approches améliorées par CRISPR comprennent :
- Correction APOE4 : Conversion de l'allèle ε4 à haut risque en variantes ε3 neuroprotectrices
- BACE1 KO : Réduire le traitement amyloïdogénique en ciblant le gène bêta-sécrétase
- Stimulants neurotrophiques : Insertion de gènes pour une production accrue de BDNF ou de NGF
Une étude révolutionnaire de 2023 Neurosciences de la nature Des cellules souches mésenchymateuses modifiées par CRISPR ont été combinées à des nanoparticules, permettant une élimination de l'amyloïde supérieure de 68% à celle des cellules non modifiées dans des modèles primates. Cette synergie illustre comment les cellules génétiquement modifiées deviennent des usines à médicaments ciblées dans le cerveau.
La tempête qui se prépare et la voie à suivre
Alors que le nombre de cas de maladie d'Alzheimer dans le monde devrait tripler pour atteindre 152 millions d'ici 2050 (Alzheimer's Disease International, 2023), l'urgence est palpable. Les récents développements cliniques soulignent le potentiel :
Les essais de phase I/II (NCT03172117, NCT02600130) montrent que la perfusion de cellules souches hématopoïétiques multicellulaires (hUC-MSC) améliore significativement les scores MMSE chez les patients atteints de MA légère à modérée, les bénéfices persistant pendant plus de 12 mois après le traitement. L'imagerie TEP révèle une accumulation réduite d'amyloïde et une activité métabolique préservée dans les régions critiques de la mémoire.
Des défis subsistent cependant : optimiser les méthodes d'administration, prévenir la sénescence cellulaire et garantir la sécurité à long terme. Les recherches les plus prometteuses portent désormais sur des approches combinatoires : des cellules souches améliorées par CRISPR administrées par voie intranasale pour contourner la barrière hémato-encéphalique, potentiellement associées à des agents biologiques anti-tau.
À la croisée des chemins interdisciplinaires, les stratégies régénératrices offrent bien plus que des progrès progressifs. Elles représentent un changement fondamental, passant de la gestion du déclin à la reconstruction de l'intégrité neuronale. Bien qu'elles ne constituent pas encore la panacée, la convergence de la biologie des cellules souches et de la précision édition génétique offre un espoir tangible que nous pourrions un jour transformer la maladie d’Alzheimer d’un diagnostic terminal en une maladie traitable, préservant non seulement les souvenirs, mais aussi les identités.
Références : Alzheimer's Disease International (2023). Rapport mondial sur la maladie d'Alzheimer. | Kim et al. (2022). Stem Cell Res Ther. 13(1):489. | Liu et al. (2023). Nat Neurosci. 26(5):765-778. | Identifiants ClinicalTrials.gov : NCT03172117, NCT02600130.