La façon dont les cellules souches se distinguent des autres cellules est l'un des processus les plus fascinants que j'ai étudiés en médecine. Ces cellules souches sont les seules cellules de l'organisme à pouvoir se transformer en plus de 200 types cellulaires spécialisés différents. Elles sont tout à fait remarquables : contrairement aux cellules normales dont la durée de vie est limitée, les cellules souches se renouvellent constamment et créent des copies exactes d'elles-mêmes.
Les cellules souches sont les éléments constitutifs de notre corps. Votre corps les utilise comme système de réparation naturel. Les cellules souches hématopoïétiques entretiennent les cellules sanguines et immunitaires, tandis que tige mésenchymateuse Les cellules soutiennent les os, le cartilage, les muscles et la graisse. Ce que j'apprécie chez ces cellules, c'est leur capacité à se transformer en différents types de cellules – des cellules sanguines aux cellules nerveuses en passant par les cellules du muscle cardiaque. Elles constituent donc un excellent moyen d'obtenir des informations pour la recherche et les traitements médicaux.
Tige thérapie cellulaire Les cellules souches embryonnaires (TP3T) sont prometteuses pour le traitement de maladies de tous types. Ceci est crucial car environ 601 TP3T d'adultes américains vivent avec une maladie chronique, ce qui démontre un réel besoin de nouveaux traitements. La liste ne cesse de s'allonger : de l'arthrite et de la sclérose en plaques à divers cancers et maladies cardiaques. Ces cellules offrent un espoir lorsque les traitements habituels s'avèrent inefficaces.
Cet article abordera la science de la reprogrammation cellulaire et la manière dont les scientifiques utilisent les cellules souches pour améliorer la médecine. Nous examinerons les mécanismes qui stimulent le développement cellulaire, les moyens les plus rapides de guider la croissance cellulaire et les applications cliniques prometteuses qui améliorent les soins aux patients.
Bases moléculaires de la différenciation des cellules souches
Source de l'image : Épigénétique clinique – BioMed Central
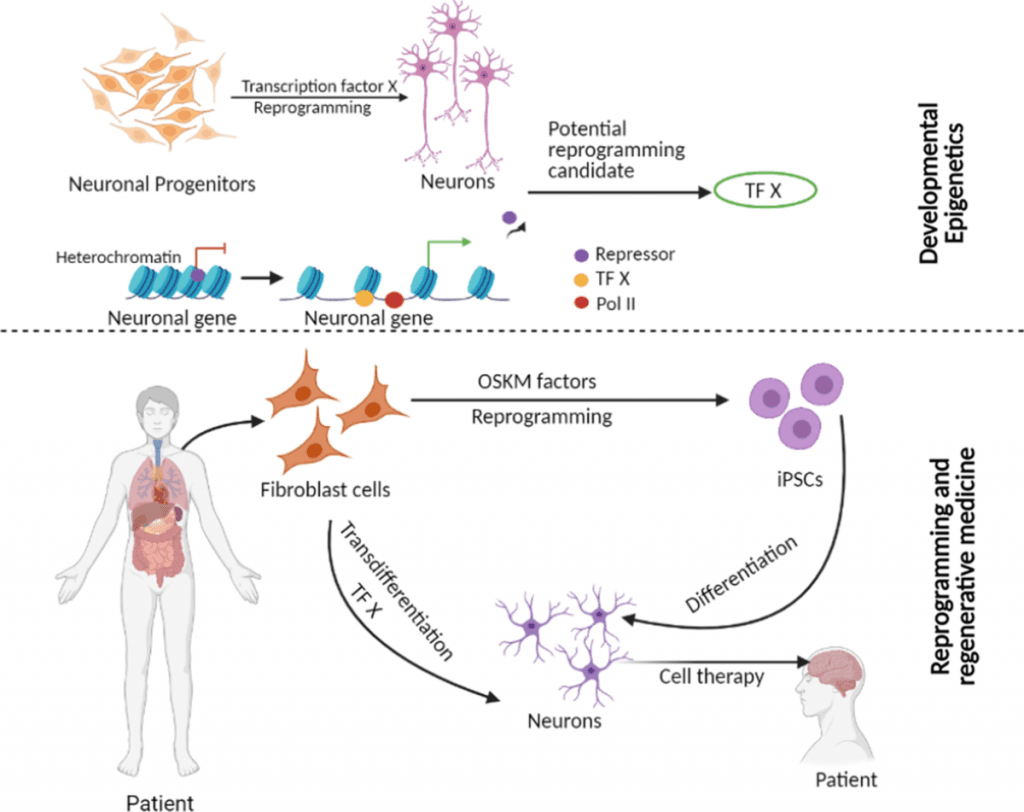
La complexité moléculaire de la séparation des cellules souches dépend de mécanismes génétiques et épigénétiques précis qui transforment des cellules non spécialisées en cellules fonctionnelles et spécifiques à un tissu. Les scientifiques considèrent désormais la compréhension de ces mécanismes comme essentielle pour faire progresser les approches de médecine régénérative.
Pluripotence vs multipotence : principales différences
La capacité de séparation d'une cellule souche définit sa puissance cellulaire. Pluripotent cellules souches Les cellules souches hématopoïétiques (CSP) peuvent se séparer en cellules des trois feuillets germinaux : ectoderme, mésoderme et endoderme. Ces cellules ne peuvent pas former de tissus extra-embryonnaires comme le placenta ou le cordon ombilical. Les cellules souches multipotentes se séparent uniquement en types cellulaires étroitement apparentés au sein d'une lignée spécifique. Les cellules souches hématopoïétiques (CSH) produisent exclusivement des types de cellules sanguines, tandis que les cellules souches mésenchymateuses (CSM) se développent en cellules osseuses, cartilagineuses, musculaires et adipeuses. Cette différence fondamentale de potentiel de séparation détermine les maladies que chaque type de cellule souche peut traiter.
Facteurs de transcription dans l'engagement de la lignée
Les facteurs de transcription (FT) agissent comme régulateurs primaires lors de la séparation des cellules souches. Parmi les FT essentiels aux cellules pluripotentes, on trouve OCT4, SOX2 et NANOG, qui maintiennent les capacités d'auto-renouvellement. Ces facteurs se lient à des séquences d'ADN spécifiques et contrôlent l'expression des gènes, essentielle au maintien de la souche.
Différents facteurs de transcription organisent les décisions relatives au destin cellulaire lors de l'engagement de la lignée. Pour citer un exemple, voir :
- RUNX2 et Osterix guident les MSC vers la formation osseuse
- PPARγ dirige l'adipogenèse
- SOX9 contrôle la différenciation chondrogénique
- GATA-1, GATA-2 et PU.1 régulent le développement hématopoïétique
Des recherches ont montré que l’activation d’un seul TF spécifique à une lignée peut convertir les cellules progénitrices en différentes lignées.
Régulation épigénétique au cours de la différenciation
Les mécanismes épigénétiques façonnent le destin des cellules souches bien au-delà des facteurs de transcription. La méthylation de l'ADN, les modifications des histones et la régulation de l'ARN non codant forment ces mécanismes.
Les gènes liés à l'auto-renouvellement deviennent progressivement silencieux, tandis que les gènes spécifiques à la lignée s'activent lors de la différenciation. Ce processus est stimulé par des modifications dynamiques des profils de méthylation de l'ADN aux sites CpG et des modifications des protéines histones. La méthylation de l'histone H3K4 active les gènes, tandis que celle de H3K27 les rend silencieux. Des enzymes modifiant la chromatine aux activités opposées permettent une régulation précise et réversible, nécessaire à la reprogrammation cellulaire.
Reprogrammation cellulaire et cellules souches pluripotentes induites (iPSC)
La reprogrammation cellulaire a révolutionné notre compréhension de la plasticité du destin cellulaire et ouvert de nouvelles perspectives en médecine régénérative. Cette section examinera comment la manipulation génétique peut ramener des cellules différenciées à un état pluripotent.
Facteurs de Yamanaka et génération d'iPSC
Shinya Yamanaka et Kazutoshi Takahashi ont fait une percée en 2006 lorsqu'ils ont reprogrammé des fibroblastes de souris en cellules pluripotentes induites. cellule souches (iPSC). Ils ont découvert quatre facteurs de transcription clés – Oct3/4, Sox2, Klf4 et c-Myc – désormais connus sous le nom de facteurs de Yamanaka, capables de transformer des cellules somatiques en cellules souches pluripotentes. Leur succès sur des fibroblastes dermiques humains adultes a suivi en 2007.
Ces facteurs de Yamanaka déclenchent des voies de signalisation vitales pour le développement, qui maintiennent la pluripotence. Plus précisément :
- Oct4 et Sox2 fonctionnent comme des facteurs essentiels dans la régulation des processus de développement
- Klf4 améliore les activités d'Oct4 et de Sox2
- c-Myc joue un rôle distinct dans les processus métaboliques
Transfert nucléaire de cellules somatiques vs reprogrammation des cellules iPSC
La reprogrammation nucléaire s'effectue par deux méthodes principales : le transfert nucléaire de cellules somatiques (TNCS) et la génération de cellules iPSC. Le TNC utilise le cytoplasme d'un ovule non fécondé pour reprogrammer le génome d'une cellule somatique et le rendre totipotent. Il s'agit du processus de reprogrammation épigénétique le plus complet. La technologie des cellules iPSC adopte une approche différente en réinitialisant les cellules somatiques par surexpression temporaire de facteurs de transcription, sans ovule humain.
Les deux méthodes permettent de créer des cellules souches pluripotentes spécifiques au patient. La SCNT fonctionne bien chez divers vertébrés, mais se heurte à des obstacles techniques, juridiques et éthiques. La reprogrammation des cellules souches pluripotentes induites (iPSC) s'avère techniquement plus simple, mais reste loin d'être aussi efficace et rapide que la SCNT.
Risques d'instabilité génétique dans les cellules reprogrammées
Les cellules iPSC sont prometteuses, mais suscitent des inquiétudes quant à leur intégrité génomique. Une analyse comparative d'hybridation génomique révèle des délétions et des amplifications dans les cellules reprogrammées. Ces signatures suggèrent un stress de réplication de l'ADN induit par un oncogène. Les modifications génomiques dépendent fortement de l'expression de c-Myc.
Le procédé présente une faible efficacité (environ 0,01–0,1%), ce qui suggère des problèmes techniques. Les cellules dont les voies p53 sont altérées se reprogramment plus facilement lorsque les scientifiques bloquent les gènes suppresseurs de tumeurs comme p53. Les cellules iPSC à passage précoce contiennent également davantage de variantes du nombre de copies que les cellules à passage intermédiaire ou les fibroblastes.
Matériels et méthodes : Culture et orientation de la différenciation
Les scientifiques ont besoin d'un contrôle précis des environnements cellulaires pour mettre en œuvre efficacement la différenciation des cellules souches. Ces dernières années, des équipes de recherche ont développé des méthodes plus sophistiquées pour cultiver et guider le développement de ces cellules polyvalentes.
Systèmes de culture sans nourrisseur pour cellules pluripotentes
Les fibroblastes embryonnaires de souris (MEF) étaient à la base de la culture traditionnelle de cellules souches. Ces cellules sécrètent des facteurs de croissance vitaux comme le TGFβ, l'activine A et des matrices extracellulaires. Les scientifiques ont développé des alternatives sans gène nourricier en utilisant Matrigel, qui contient de la laminine, du collagène IV et des protéoglycanes sulfate d'héparine. Matrigel favorise la croissance des cellules souches grâce à des formulations de milieux définies et constitue l'une des premières alternatives à la culture dépendante du gène nourricier. L'origine du sarcome de souris présente des risques de contamination xénogénique.
Les scientifiques ont développé des substrats plus précis, notamment des isoformes spécifiques de laminine (-511/-521), la vitronectine et l'E-cadhérine. Les plateformes à base de polymères synthétiques ont amélioré la reproductibilité avec des hydrogels zwitterioniques comme le PMEDSAH et l'aminopropylméthacrylamide (APMAAm). Les surfaces à base de graphène semblent prometteuses pour maintenir la pluripotence sans revêtement de matrice extracellulaire.
Protocoles de facteurs de croissance pour la différenciation dirigée
Les scientifiques exposent les cellules à des facteurs de croissance spécifiques qui reflètent les signaux de développement afin de diriger la différenciation des cellules souches. Les protocoles essentiels commencent par :
- Formation de corps embryoïdes (EB) par agrégation cellulaire en culture en suspension
- Différenciation monocouche avec exposition séquentielle aux facteurs de croissance
Des combinaisons spécifiques de facteurs de croissance guident le développement spécifique de chaque lignée. La différenciation neuronale nécessite un supplément de bFGF, d'héparine et d'azote. Les cellules souches embryonnaires âgées de dix jours développent naturellement une différenciation cardiaque, tandis que l'activine A stimule l'induction de l'endoderme. BMP-4, TGF-β1, acide rétinoïque et HGF guident les cellules vers des destins spécifiques en activant des voies de signalisation distinctes.
Modèles organoïdes 3D pour le développement tissulaire spécifique
Les scientifiques ont dépassé la simple différenciation pour créer des modèles organoïdes 3D complexes qui reproduisent l'architecture tissulaire. Les cellules souches forment des organoïdes grâce à leurs capacités d'auto-organisation au sein de matrices 3D de soutien. Ces structures développent une morphologie plus complexe que les cultures traditionnelles et offrent une meilleure modélisation du développement tissulaire.
Les scientifiques initient des organoïdes en intégrant des cellules souches dans des hydrogels tels que le Matrigel, l'alginate ou des matrices synthétiques de PEG. Les propriétés physiques de la matrice, combinées à des bioréacteurs fournissant les nutriments essentiels, améliorent le développement des organoïdes. Cette méthode a permis de créer des modèles d'intestin, de cerveau, de rein et de foie, qui constituent un excellent moyen d'obtenir des informations pour la modélisation des maladies et le criblage de médicaments.
Résultats et discussion : applications cliniques des cellules souches différenciées
Ces dernières années, les scientifiques ont transformé les possibilités théoriques des traitements par cellules souches en thérapies concrètes. Leurs recherches rigoureuses et leurs essais cliniques permettent désormais de traiter des maladies auparavant incurables.
Réparation cardiaque à l'aide de cardiomyocytes dérivés d'iPSC
Les cardiomyocytes dérivés d'iPSC (iPSC-CM) présentent un potentiel remarquable pour le traitement de l'insuffisance cardiaque et de l'infarctus du myocarde. La transplantation de ces cellules dans des cœurs endommagés a augmenté la fraction d'éjection ventriculaire gauche de 8,23% par rapport aux groupes témoins. La fonction cardiaque s'est particulièrement améliorée entre 4 et 8 semaines après le traitement, mais son efficacité a diminué au-delà de cette période.
Des recherches sur des primates non humains ont révélé que l'association d'iPSC-CM avec des cellules endothéliales améliorait la taille du greffon, la formation des vaisseaux sanguins et la fonction cardiaque après une reperfusion ischémique. Ces améliorations provenaient de la remuscularisation des tissus endommagés et d'une meilleure vascularisation des greffons.
Régénération neuronale dans les modèles de la maladie de Parkinson
Les cellules souches neurales (NSC) dérivées d'iPSC sont très prometteuses pour le traitement de la maladie de Parkinson. les cellules peuvent se transforment en neurones dopaminergiques, le principal type cellulaire perdu dans la MP. Les cellules transplantées survivent et contribuent à la sécrétion de dopamine et au soutien trophique.
Les essais cliniques ont démontré l'innocuité de la transplantation de cellules souches neurales (CSN) et ont montré une amélioration de la fonction motrice chez les patients atteints de MP. Les CSN dérivées de cellules souches neurales iPSC humaines, dont le gène SNCA a été désactivé, ont amélioré la coordination, l'équilibre et la motricité des modèles murins. Les souris ont finalement vécu plus longtemps.
Liste des maladies traitées par les cellules souches dans les essais cliniques
Les essais cliniques utilisent désormais des thérapies à base de cellules souches pour traiter de nombreuses pathologies :
- troubles sanguins:Leucémie, lymphome, myélome multiple
- Affections neurologiques: maladie de Parkinson, maladie d'Alzheimer, SLA
- Maladies cardiovasculaires: Insuffisance cardiaque, infarctus du myocarde
- troubles immunitaires: Sclérose en plaques, diabète de type 1
- Autres conditions:Arthrose, fistules périanales dans la maladie de Crohn
Les médecins utilisent avec succès les greffes de cellules souches hématopoïétiques (greffes de moelle osseuse) depuis des décennies, principalement pour traiter les cancers du sang. Les cellules souches constituent un excellent moyen d'obtenir de l'aide lorsque les traitements habituels ne sont pas suffisamment efficaces. Cependant, des recherches supplémentaires sont nécessaires avant qu'une utilisation généralisée ne soit possible.
Conclusion
Cet article explore le parcours remarquable des cellules souches, passant d'un état indifférencié à des cellules spécialisées dotées de fonctions spécifiques. Les mécanismes moléculaires à l'origine de la différenciation – des facteurs de transcription comme OCT4 et SOX2 aux modifications épigénétiques complexes – illustrent la programmation biologique complexe qui guide le développement cellulaire. Les scientifiques ont démontré que les cellules adultes pouvaient être reprogrammées vers un état pluripotent grâce aux facteurs de Yamanaka, ce qui a sans aucun doute révolutionné notre compréhension. Ce processus se heurte encore à des difficultés de stabilité génétique.
Les scientifiques ont révolutionné la recherche sur les cellules souches grâce à des techniques de culture avancées. Ils utilisent désormais des systèmes sophistiqués et sont passés de simples couches nourricières à des substrats définis. Des modèles organoïdes 3D complexes, plus proches des environnements tissulaires naturels, permettent un contrôle plus précis des voies de différenciation et une meilleure modélisation des maladies humaines.
Les applications cliniques des cellules souches différenciées se développent rapidement. Ces thérapies offrent de l'espoir pour des pathologies autrefois considérées comme incurables, de la régénération du tissu cardiaque à la transplantation de cellules nerveuses pour la maladie de Parkinson. De nombreuses applications restent expérimentales, mais des traitements efficaces comme les greffes de cellules souches hématopoïétiques révèlent leur véritable potentiel.
Ce domaine doit relever plusieurs défis. Les scientifiques doivent améliorer l'efficacité de la différenciation, garantir la stabilité génétique et accroître la production pour une utilisation clinique. La science derrière la reprogrammation cellulaire continue de progresser, et les thérapies à base de cellules souches deviendront des éléments clés de la médecine moderne. Ces thérapies offriront des options de traitement personnalisées aux patients du monde entier. Le cheminement des résultats de laboratoire au traitement au chevet du patient montre comment la recherche biologique fondamentale peut transformer la pratique clinique et changer la vie humaine.