La lenta erosión de la memoria y del yo en la enfermedad de Alzheimer (EA) representa uno de los desafíos más profundos de la medicina moderna. A medida que presenciamos cómo los seres queridos se desvanecen en la sombra cognitiva, las limitaciones de las terapias convencionales se hacen dolorosamente evidentes. Sin embargo, investigaciones recientes sugieren que podríamos estar acercándonos a un punto de inflexión, donde la medicina regenerativa ofrece más que un alivio sintomático, pudiendo reescribir la trayectoria de la enfermedad.
Entendiendo el panorama del Alzheimer
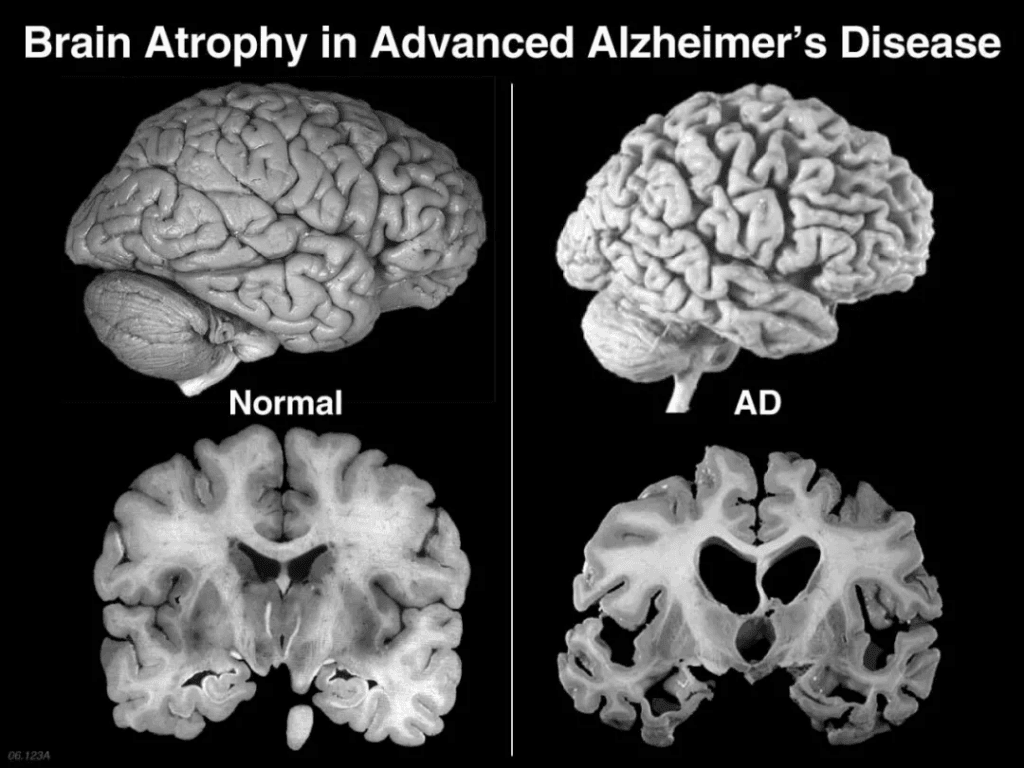
El Alzheimer no se trata simplemente de "olvido". Este trastorno neurodegenerativo destruye progresivamente las neuronas, caracterizándose patológicamente por placas de beta-amiloide y ovillos neurofibrilares de tau. El caos sináptico se manifiesta mediante la desintegración de la memoria, confusión, cambios de personalidad y, finalmente, la pérdida de funciones corporales. Los medicamentos actuales aprobados por la FDA (inhibidores de la acetilcolinesterasa y antagonistas de NMDA) ofrecen un retraso sintomático moderado, pero no logran detener la neurodegeneración. Este impasse terapéutico ha impulsado la exploración de enfoques regenerativos.
hUC-MSC: más que un simple reemplazo celular
cordón umbilical humano Las células madre mesenquimales derivadas del cordón umbilical (hUC-MSC) poseen propiedades biológicas únicas que las posicionan como prometedoras terapias para la enfermedad de Alzheimer. A diferencia de las células madre embrionarias, estas células de origen ético presentan baja inmunogenicidad y potentes funciones inmunomoduladoras. Su mecanismo terapéutico va más allá del reemplazo neuronal:
Señalización paracrina: Las hUC-MSC secretan factores neurotróficos (BDNF, GDNF) que rescatan las neuronas dañadas y estimulan la regeneración sináptica.
Modulación microglial: Suprimen la neuroinflamación convirtiendo la microglía destructiva en fenotipos neuroprotectores.
Aclaramiento de amiloide: A través de una mejor fagocitosis y degradación enzimática (regulación positiva de neprilisina).
Cabe destacar que en 2022 Célula madre Investigación y terapia Un estudio demostró que las hUC-MSC intravenosas en ratones con EA redujeron la carga amiloide en 40% y mejoraron las puntuaciones cognitivas al dirigirse selectivamente a las regiones inflamadas del cerebro, un sistema de “triaje” biológico que apenas estamos comenzando a comprender.
CRISPR: Ingeniería de precisión para la neurodegeneración
 Mientras células madre Si bien proporciona hardware biológico, la edición génica CRISPR-Cas9 ofrece la actualización de software. Este bisturí molecular permite la modificación precisa de genes asociados a enfermedades en células madre antes del trasplante. En el contexto de la enfermedad de Alzheimer, los enfoques mejorados con CRISPR incluyen:
Mientras células madre Si bien proporciona hardware biológico, la edición génica CRISPR-Cas9 ofrece la actualización de software. Este bisturí molecular permite la modificación precisa de genes asociados a enfermedades en células madre antes del trasplante. En el contexto de la enfermedad de Alzheimer, los enfoques mejorados con CRISPR incluyen:
- Corrección APOE4: Conversión del alelo ε4 de alto riesgo en variantes neuroprotectoras ε3
- Eliminación de BACE1: Reducción del procesamiento amiloidogénico mediante la focalización del gen beta-secretasa
- Potenciadores neurotróficos: Inserción de genes para mejorar la producción de BDNF o NGF
Un estudio innovador de 2023 en Neurociencia de la naturaleza Se combinaron células madre mesenquimales (MSC) editadas mediante CRISPR con administración de nanopartículas, logrando una mayor eliminación de amiloide (68%) que las células no modificadas en modelos de primates. Esta sinergia ejemplifica cómo las células modificadas se convierten en fábricas de fármacos específicos dentro del cerebro.
La tormenta que se avecina y un camino a seguir
Dado que se proyecta que los casos mundiales de EA se triplicarán hasta alcanzar los 152 millones para 2050 (Alzheimer's Disease International, 2023), la urgencia es palpable. Los recientes avances clínicos subrayan su potencial:
Los ensayos de fase I/II (NCT03172117, NCT02600130) muestran que la infusión de hUC-MSC mejora significativamente las puntuaciones del MMSE en pacientes con EA de leve a moderada, con beneficios que persisten durante más de 12 meses después del tratamiento. Las imágenes PET revelan una menor acumulación de amiloide y una actividad metabólica preservada en regiones críticas de memoria.
Sin embargo, persisten desafíos: optimizar los métodos de administración, prevenir la senescencia celular y garantizar la seguridad a largo plazo. La investigación más prometedora se centra ahora en enfoques combinatorios: células madre mejoradas con CRISPR administradas por vía intranasal para eludir la barrera hematoencefálica, posiblemente combinadas con productos biológicos anti-tau.
En esta encrucijada interdisciplinaria, las estrategias regenerativas ofrecen más que un progreso gradual. Representan un cambio fundamental: de la gestión del deterioro a la reconstrucción de la integridad neuronal. Si bien aún no es la panacea, la convergencia de la biología de células madre y la precisión... edición genética Proporciona una esperanza tangible de que algún día podamos transformar el Alzheimer de un diagnóstico terminal a una condición tratable, preservando no sólo los recuerdos, sino también las identidades.
Referencias: Alzheimer's Disease International (2023). Informe Mundial sobre el Alzheimer. | Kim et al. (2022). Stem Cell Res Ther. 13(1):489. | Liu et al. (2023). Nat Neurosci. 26(5):765-778. | Identificadores de ClinicalTrials.gov: NCT03172117, NCT02600130.