La forma en que las células madre se distinguen de otras células es uno de los procesos más fascinantes que he estudiado en medicina. Estas células maestras se destacan como las únicas células del cuerpo capaces de transformarse en más de 200 tipos celulares especializados. Son realmente extraordinarias: a diferencia de las células normales, que tienen una vida útil limitada, las células madre se renuevan constantemente y crean copias exactas de sí mismas.
Las células madre son los componentes básicos que conforman nuestro cuerpo. El cuerpo las utiliza como su sistema de reparación natural. Las células madre hematopoyéticas mantienen las células sanguíneas e inmunitarias, mientras que... tallo mesenquimal Las células sostienen los huesos, el cartílago, los músculos y la grasa. Lo que me encanta de estas células es su capacidad para transformarse en diferentes tipos de células, desde células sanguíneas hasta células nerviosas y células del músculo cardíaco. Esto las convierte en una excelente fuente de información para la investigación y el tratamiento médico.
Provenir terapia celular Se muestra prometedor para el tratamiento de enfermedades de todo tipo. Esto se vuelve crucial, ya que aproximadamente el 60% de los adultos estadounidenses padecen una enfermedad crónica, lo que demuestra una necesidad real de nuevos tratamientos. La lista sigue creciendo, desde la artritis y la esclerosis múltiple hasta diversos tipos de cáncer y enfermedades cardíacas. Estas células ofrecen esperanza cuando los tratamientos habituales no funcionan.
Este artículo profundizará en la ciencia de la reprogramación celular y en cómo los científicos utilizan las células madre para transformar la medicina. Analizaremos qué impulsa el desarrollo celular, las maneras más rápidas de guiar el crecimiento celular y los interesantes usos clínicos que están mejorando la atención al paciente.
Base molecular de la diferenciación de células madre
Fuente de la imagen: Epigenética clínica – BioMed Central
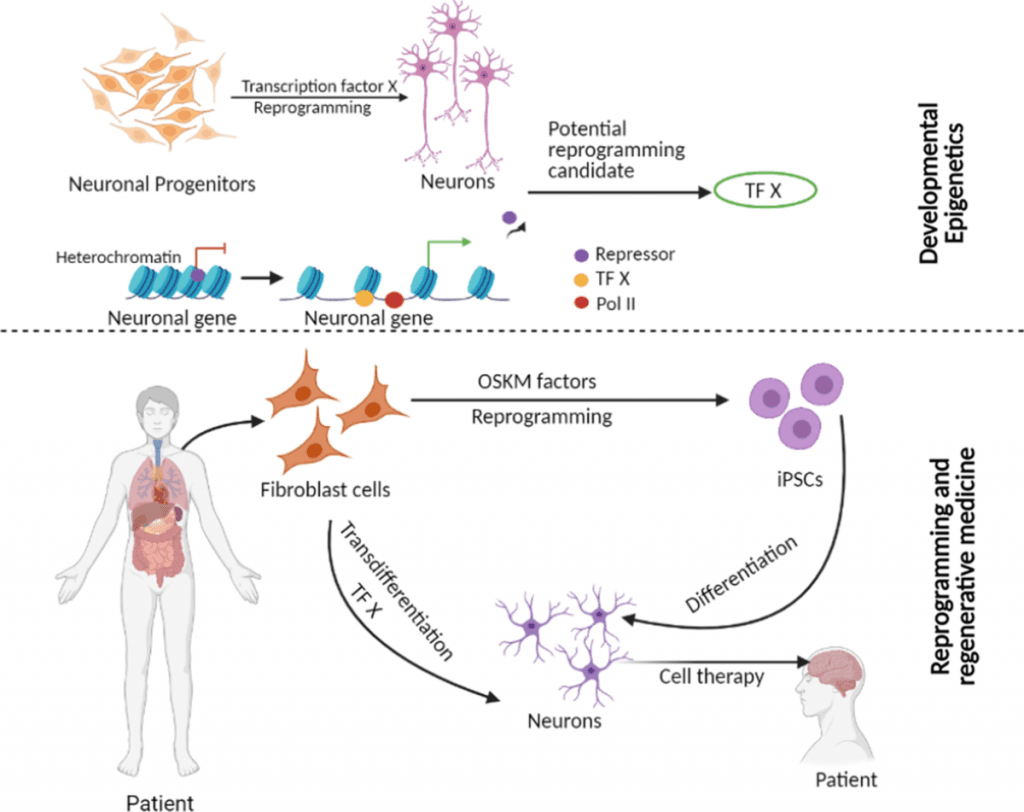
La complejidad molecular de la separación de células madre depende de mecanismos genéticos y epigenéticos detallados que transforman células no especializadas en células funcionales y específicas para cada tejido. Los científicos consideran ahora que comprender estos mecanismos es crucial para avanzar en los enfoques de la medicina regenerativa.
Pluripotencia vs. Multipotencia: Diferencias Clave
La capacidad de separación de una célula madre define su potencia celular. Pluripotente. células madre Las células madre pluripotentes (CMP) pueden separarse en células de las tres capas germinales: ectodermo, mesodermo y endodermo. Estas células no pueden formar tejidos extraembrionarios como la placenta o el cordón umbilical. Las células madre multipotentes se separan únicamente en tipos celulares estrechamente relacionados dentro de un linaje específico. Las células madre hematopoyéticas (CMH) producen exclusivamente tipos de células sanguíneas, y las células madre mesenquimales (CMS) se convierten en células óseas, cartilaginosas, musculares y adiposas. Esta diferencia fundamental en el potencial de separación determina las enfermedades que cada tipo de célula madre podría tratar.
Factores de transcripción en el compromiso de linaje
Los factores de transcripción (FT) actúan como reguladores primarios durante la separación de células madre. Los FT esenciales para las células pluripotentes incluyen OCT4, SOX2 y NANOG, que mantienen la capacidad de autorrenovación. Estos factores actúan uniéndose a secuencias específicas de ADN y controlan la expresión génica, esencial para mantener la pluripotencia.
Diferentes TF organizan las decisiones sobre el destino celular durante el compromiso de linaje. Para citar un ejemplo, véase:
- RUNX2 y Osterix guían a las MSC hacia la formación ósea
- PPARγ dirige la adipogénesis
- SOX9 controla la diferenciación condrógena
- GATA-1, GATA-2 y PU.1 regulan el desarrollo hematopoyético
Las investigaciones han demostrado que la activación de incluso un único TF específico de un linaje puede convertir las células progenitoras en linajes diferentes.
Regulación epigenética durante la diferenciación
Los mecanismos epigenéticos influyen significativamente en el destino de las células madre, más allá de los factores de transcripción. La metilación del ADN, las modificaciones de las histonas y la regulación del ARN no codificante conforman estos mecanismos.
Los genes vinculados a la autorrenovación se silencian progresivamente, mientras que los genes específicos de linaje se activan durante la diferenciación. Los cambios dinámicos en los patrones de metilación del ADN en los sitios CpG y las modificaciones de las histonas impulsan este proceso. La metilación en la histona H3K4 activa los genes, mientras que la metilación en H3K27 los silencia. Las enzimas modificadoras de la cromatina con actividades opuestas permiten la regulación precisa y reversible necesaria para la reprogramación celular.
Reprogramación celular y células madre pluripotentes inducidas (iPSC)
La reprogramación celular revolucionó nuestra comprensión de la plasticidad del destino celular y abrió nuevas posibilidades en la medicina regenerativa. Esta sección analizará cómo la manipulación genética puede revertir las células diferenciadas a un estado pluripotente.
Factores de Yamanaka y generación de iPSC
Shinya Yamanaka y Kazutoshi Takahashi hicieron un gran avance en 2006 cuando reprogramaron fibroblastos de ratón para convertirlos en células pluripotentes inducidas. célula madres (iPSC). Descubrieron cuatro factores de transcripción clave: Oct3/4, Sox2, Klf4 y c-Myc, ahora conocidos como factores de Yamanaka, que podrían convertir células somáticas en células madre pluripotentes. Su éxito con fibroblastos dérmicos humanos adultos se produjo en 2007.
Estos factores de Yamanaka activan vías de señalización vitales para el desarrollo que mantienen la pluripotencia. En concreto:
- Oct4 y Sox2 funcionan como factores centrales en la regulación de los procesos de desarrollo.
- Klf4 mejora las actividades de Oct4 y Sox2
- c-Myc juega un papel diferenciado en los procesos metabólicos
Transferencia nuclear de células somáticas frente a reprogramación de iPSC
La reprogramación nuclear se realiza mediante dos métodos principales: la transferencia nuclear de células somáticas (TNCS) y la generación de células iPS. La TNCS utiliza el citoplasma de un óvulo no fecundado para reprogramar el genoma de una célula somática a un estado totipotente. Esto representa el proceso de reprogramación epigenética más completo. La tecnología de células iPS adopta un enfoque diferente al restablecer las células somáticas mediante la sobreexpresión temporal de factores de transcripción sin óvulos humanos.
Ambos métodos permiten crear células madre pluripotentes específicas para cada paciente. La SCNT funciona bien en diversos vertebrados, pero enfrenta obstáculos técnicos, legales y éticos. La reprogramación de células madre pluripotentes inducidas (CPI) resulta técnicamente más sencilla, pero no es tan eficiente ni rápida como la SCNT.
Riesgos de inestabilidad genética en células reprogramadas
Las iPSC son prometedoras, pero plantean dudas sobre su integridad genómica. El análisis comparativo de hibridación genómica muestra deleciones y amplificaciones en células reprogramadas. Estas características apuntan a un estrés en la replicación del ADN inducido por oncogenes. Los cambios genómicos dependen en gran medida de la expresión de c-Myc.
El proceso muestra una baja eficiencia (aproximadamente 0,01-0,11 TP3T), lo que sugiere problemas con la técnica. Las células con vías p53 alteradas se reprograman con mayor facilidad cuando los científicos bloquean genes supresores de tumores como p53. Las iPSC de pasaje temprano también contienen más variantes en el número de copias que las células de pasaje intermedio o los fibroblastos.
Materiales y métodos: cultivo y dirección de la diferenciación
Los científicos necesitan un control preciso del entorno celular para implementar eficazmente la diferenciación de células madre. En los últimos años, los equipos de investigación han desarrollado métodos más sofisticados para cultivar y guiar el desarrollo de estas versátiles células.
Sistemas de cultivo sin alimentador para células pluripotentes
Los fibroblastos embrionarios de ratón (FEM) fueron la base del cultivo tradicional de células madre. Estas células secretaban factores de crecimiento vitales como el TGFβ, la activina A y matrices extracelulares. Los científicos desarrollaron alternativas sin alimentación utilizando Matrigel, que contiene laminina, colágeno IV y proteoglicanos de sulfato de heparina. Matrigel favorece el crecimiento de células madre con formulaciones de medios definidas y se erige como una de las primeras alternativas al cultivo dependiente de alimentación. El origen del sarcoma murino conlleva riesgos de contaminación xenogénica.
Los científicos desarrollaron sustratos más definidos, incluyendo isoformas específicas de laminina (-511/-521), vitronectina y E-cadherina. Las plataformas basadas en polímeros sintéticos mejoraron la reproducibilidad con hidrogeles zwitteriónicos como PMEDSAH y aminopropilmetacrilamida (APMAAm). Las superficies basadas en grafeno son prometedoras para mantener la pluripotencia sin un recubrimiento de matriz extracelular.
Protocolos de factores de crecimiento para la diferenciación dirigida
Los científicos exponen las células a factores de crecimiento específicos que reflejan las señales de desarrollo para dirigir la diferenciación de las células madre. Los protocolos esenciales comienzan con:
- Formación del cuerpo embrioide (CE) mediante agregación celular en cultivo en suspensión
- Diferenciación de monocapa con exposición secuencial a factores de crecimiento
Combinaciones específicas de factores de crecimiento guían el desarrollo específico de cada linaje. La diferenciación neuronal requiere bFGF, heparina y suplemento de N2. Los CE de diez días desarrollan de forma natural la diferenciación cardíaca, mientras que la activina A impulsa la inducción del endodermo. BMP-4, TGF-β1, ácido retinoico y HGF guían a las células hacia destinos específicos mediante la activación de vías de señalización específicas.
Modelos de organoides 3D para el desarrollo específico de tejidos
Los científicos han avanzado más allá de la simple diferenciación para crear complejos modelos 3D de organoides que reflejan la arquitectura tisular. Las células madre forman organoides gracias a su capacidad de autoorganización dentro de matrices 3D de soporte. Estas estructuras desarrollan una morfología más compleja que los cultivos tradicionales y proporcionan un mejor modelado del desarrollo tisular.
Los científicos crean organoides mediante la incorporación de células madre en hidrogeles como Matrigel, alginato o matrices sintéticas de PEG. Las propiedades físicas de la matriz, combinadas con biorreactores que aportan nutrientes esenciales, mejoran el desarrollo de los organoides. Este método ha creado modelos de intestino, cerebro, riñón e hígado que constituyen una excelente manera de obtener información para el modelado de enfermedades y el cribado de fármacos.
Resultados y discusión: aplicaciones clínicas de células madre diferenciadas
En los últimos años, los científicos han convertido las posibilidades teóricas de los tratamientos con células madre en terapias reales. Sus rigurosas investigaciones y ensayos clínicos ahora ayudan a tratar afecciones que antes eran intratables.
Reparación cardíaca mediante cardiomiocitos derivados de células iPS
Los cardiomiocitos derivados de iPSC (iPSC-CM) muestran un potencial notable para tratar la insuficiencia cardíaca y el infarto de miocardio. El trasplante de estas células a corazones dañados aumentó la fracción de eyección del ventrículo izquierdo en 8,23% en comparación con los grupos control. La función cardíaca mejoró más durante las 4-8 semanas posteriores al tratamiento, pero su eficacia disminuyó después de este período.
Investigaciones en primates no humanos revelaron que la combinación de CM-iPS con células endoteliales mejoró el tamaño del injerto, la formación de vasos sanguíneos y la función cardíaca tras la reperfusión isquémica. Estas mejoras se debieron a la remuscularización del tejido dañado y a una mejor vascularización dentro de los injertos.
Regeneración neuronal en modelos de la enfermedad de Parkinson
Las células madre neurales (CMN) derivadas de iPSC son muy prometedoras para el tratamiento de la enfermedad de Parkinson. Estas Las células pueden Se convierten en neuronas dopaminérgicas, el principal tipo celular perdido en la EP. Las células trasplantadas sobreviven y contribuyen mediante la secreción de dopamina y el soporte trófico.
Los ensayos clínicos demostraron la seguridad del trasplante de células madre neurales (CMNE) y mostraron una mejor función motora en pacientes con EP. Las CMNE derivadas de iPSC humanas con la inhibición del gen SNCA ayudaron a los modelos murinos a mejorar la coordinación, el equilibrio y el movimiento. Los ratones finalmente vivieron más tiempo.
Lista de enfermedades tratadas con células madre en ensayos clínicos
Los ensayos clínicos ahora utilizan terapias con células madre para tratar muchas afecciones:
- Trastornos de la sangre: Leucemia, linfoma, mieloma múltiple
- Afecciones neurológicas:Enfermedad de Parkinson, Alzheimer, ELA
- enfermedades cardiovasculares: Insuficiencia cardíaca, infarto de miocardio
- Trastornos inmunitarios:Esclerosis múltiple, diabetes tipo 1
- Otras condiciones: Osteoartritis, fístulas perianales en la enfermedad de Crohn
Los médicos han utilizado con éxito los trasplantes de células madre hematopoyéticas (trasplantes de médula ósea) durante décadas, principalmente para tratar cánceres hematológicos. Las células madre son una excelente opción cuando los tratamientos habituales no son eficaces. Sin embargo, se necesita más investigación antes de que su uso generalizado sea posible.
Conclusión
Este artículo explora la extraordinaria evolución de las células madre a medida que cambian de su estado indiferenciado a células especializadas con funciones específicas. Los mecanismos moleculares que impulsan la diferenciación —desde factores de transcripción como OCT4 y SOX2 hasta complejas modificaciones epigenéticas— muestran la intrincada programación biológica que guía el desarrollo celular. Los científicos demostraron que las células adultas podían reprogramarse para volver a un estado pluripotente mediante los factores de Yamanaka, lo que sin duda revolucionó nuestra comprensión. El proceso aún enfrenta desafíos en cuanto a estabilidad genética.
Los científicos han transformado el panorama de la investigación con células madre mediante técnicas de cultivo avanzadas. Ahora trabajan con sistemas sofisticados y han pasado de simples capas de alimentación a sustratos definidos. Los complejos modelos 3D de organoides que imitan mejor los entornos tisulares naturales permiten un control más preciso de las vías de diferenciación y un mejor modelado de enfermedades humanas.
Las aplicaciones clínicas de las células madre diferenciadas se expanden rápidamente. Estas terapias ofrecen esperanza para afecciones que antes se consideraban intratables, desde la regeneración del tejido cardíaco hasta el trasplante de células neuronales para la enfermedad de Parkinson. Muchas aplicaciones siguen siendo experimentales, pero tratamientos exitosos como los trasplantes de células madre hematopoyéticas demuestran su verdadero potencial.
El campo debe superar varios desafíos futuros. Los científicos necesitan mejorar la eficiencia de la diferenciación, garantizar la estabilidad genética y escalar la producción para uso clínico. La ciencia detrás de la reprogramación celular continúa avanzando, y las terapias con células madre se convertirán en componentes clave de la medicina moderna. Estas terapias ofrecerán opciones de tratamiento personalizadas para pacientes de todo el mundo. El paso de los hallazgos de laboratorio al tratamiento en la cama del paciente demuestra cómo la investigación biológica fundamental puede transformar la práctica clínica y transformar la vida de las personas.